Introduzione
Le ghiandole di Meibomio sono ghiandole secretorie situate nelle palpebre superiori ed inferiori. Esse rilasciano nella superficie oculare un secreto, per la maggior parte formato da lipidi, detto meibum, creando così lo strato più superficiale del film lacrimale. Il meibum si distribuisce uniformemente grazie all’azione delle palpebre, promuovendo stabilità del film lacrimale e prevenendo una rapida evaporazione dello stesso.
La disfunzione delle ghiandole di Meibomio (DMG) è considerata la principale causa della sindrome dell’occhio secco. L’International Workshop sulla disfunzione delle ghiandole di Meibomio ha classificato questa condizione come una cronica e diffusa anomalia delle ghiandole, comunemente caratterizzata dall’ostruzione dei dotti terminali e/o da variazioni qualitative o quantitative della secrezione ghiandolare. Ciò può portare all’alterazione della stabilità del film lacrimale e si presenta dopo un controllo clinico come un’infiammazione o disturbo della superficie oculare (Nichols et al., 2011).
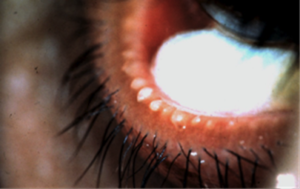
La DGM produce un’alterazione della secrezione lipidica, che comporta come conseguenza un aumento del tasso di evaporazione del film lacrimale. Nella DGM l’espressibilità e la consistenza del meibum sono alterati, il colore del secreto va da un trasparente-giallognolo ad un bianco opaco e la viscosità aumenta, fino ad apparire simile ad una pasta cerosa (Fig. 1). Ciò è causato da un’alterazioni delle componenti del secreto ghiandolare. Circa il 30% dei lipidi polari del meibum è composto da sfingolipidi, ma nella fase acuta della DGM la quantità accresce notevolmente. L’elevata concentrazione di sfingolipidi nel meibum ne aumenta il punto di fusione, donandogli un aspetto solido-ceroso (Arciniega et al., 2013).
Figura 1: DGM in cui il meibum ha un aspetto ceroso e di colore bianco opaco (Tomlinson et al., 2011)
Discomfort da lenti a contatto
Il discomfort da lenti a contatto (LAC) è spesso riconosciuto clinicamente sulla base dei sintomi riferiti dai pazienti quali secchezza, bruciore, sensazione di corpo estraneo, disidratazione della lente a contatto, che possono presentarsi soprattutto a fine giornata (Nichols et al., 2011). Questo fenomeno è caratterizzato da un disagio legato alla lente, sporadico o persistente, correlato o meno a disturbi visivi ed è il risultato di una ridotta biocompatibilità fra lente a contatto e superficie oculare. Ciò conduce ad un periodo di porto ridotto o all’abbandono relativo o totale del porto di lenti.
L’occhio secco indotto dal porto di lenti a contatto (CLIDE) è un termine specifico utilizzato per riferirsi a quelle situazioni in cui la sintomatologia scompare dopo la rimozione delle LAC. Come per la sindrome dell’occhio secco, anche la CLIDE è multifattoriale e la sua incidenza è maggiore tra i portatori di lenti a contatto morbide. Allo stesso modo, è più frequente con lenti idrogel rispetto alle silicone idrogel (Chalmers et al., 2008), nelle LAC riutilizzabili rispetto alle giornaliere (Varikooty et al., 2013), e nelle toriche rispetto alle sferiche (Young et al., 2011). Una causa associabile a questa intolleranza alle LAC è l’elevato contenuto idrico: in presenza di un eccessivo tasso di evaporazione del film lacrimale pre-lente, la lente a contatto si disidrata notevolmente attingendo al reservoir lacrimale per rimanere idratata. Per questo motivo le lenti in SiHy sono meno dipendenti dalla dinamica lacrimale del soggetto, in quanto presentano un minor contenuto idrico all’interno del polimero.
Inoltre, anche la scarsa bagnabilità del materiale di cui è costituita la LAC è fortemente associata ai sintomi del CLIDE. Sotto questo punto di vista il silicone idrogel sembra avere una ridotta performance in quanto l’angolo di bagnabilità è ridotto notevolmente rispetto alle LAC in idrogel e in aggiunta adsorbe maggiormente depositi lipidici quali colesterolo, trigliceridi e fosfolipidi (Maissa et al., 2014). In un soggetto che presenta DGM la lente in silicone idrogel non è quindi la scelta primaria.
Diversi studi hanno evidenziato inoltre che il porto di lenti a contatto possa alterare significativamente la qualità e l’espressibilità del meibum. Nello studio condotto da Cox e colleghi (Cox et al., 2016) è emerso che l’espressibilità del meibum è direttamente associata al comfort delle lenti a contatto. Inoltre, il punto di fusione del meibum nei portatori è di 3°C superiore rispetto ai soggetti di controllo (Ong, Larke, 1990) mentre la qualità del meibum risulta alterata (Machalinska et al., 2015). Ciò comporta un’instabilità dello strato lipidico e di conseguenza di tutto il film lacrimale. I punti di rottura del film lacrimale pre-lente che si formano precocemente rispetto alla frequenza di ammiccamento sono spesso la causa della disidratazione eccessiva della lente a contatto. L’effetto meccanico e l’assorbimento del film lacrimale da parte della lente disidratata provocano sofferenza cellulare epiteliale, visibile attraverso l’instillazione di coloranti sotto forma di staining corneale e congiuntivale.
Un ulteriore fattore in grado di alterare la tolleranza delle LAC è la frizione presente tra il lid wiper e la lente a contatto. Una ridotta lubrificazione della superficie della lente aumenta il coefficiente di frizione, provocando uno stress cellulare nella zona palpebrale (lid wiper epitheliopathy). Per lubrificazione si intende la presenza di un liquido interposto tra due oggetti solidi, in questo caso LAC e palpebra. Quindi, un film lacrimale pre-lente di spessore ridotto causato da un’alterata qualità dello stesso o dalla disidratazione della LAC aumenta il disagio ad ogni ammiccamento. Inoltre, anche la forza applicata durante l’ammiccamento (ammiccamenti forzati) e la velocità dell’ammiccamento possono aumentare il coefficiente di frizione.
Le lenti a contatto rigide gas permeabili (RGP) non risentono della disidratazione in quanto non presentano all’interno del materiale un contenuto idrico. Tuttavia, la geometria del bordo della lente e la tipologia di materiale sono molto importanti per offrire un buon comfort durante il porto. Un sollevamento del bordo della lente rispetto alla cornea è necessario per mantenere un ricambio lacrimale post-lente, però se questo risulta eccessivo può innalzare il coefficiente di frizione con le palpebre e generare intolleranza. Ne risulta che ad ogni ammiccamento il lid wiper viene sollecitato; a lungo andare il soggetto potrebbe subire alterazioni dell’ammiccamento, in frequenza e qualità, e soffrire di disidratazione corneale e congiuntivale ore 3-9. Anche la forma e lo spessore del bordo possono inficiare sulla comodità della lente: un bordo a punta risulta più fastidioso rispetto ad un bordo smussato, mentre uno spessore maggiore viene percepito di più dal soggetto rispetto ad un bordo sottile.
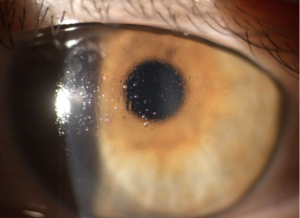
Come per le LAC morbide, anche nelle lenti rigide il materiale è importante per ottimizzare la stabilità e distribuzione del film lacrimale. Materiali ad alto contenuto di silicone offrono una minor bagnabilità, ridotta distribuzione del film ed un maggior adsorbimento di depositi lipidici (Fig. 2). In questo caso è bene ricordare al portatore di seguire attentamente la procedura di pulizia delle LAC attraverso l’uso di detergenti specifici; nel caso in cui vi fossero presenti depositi di tipo lipidico è consigliabile un detergente a base alcolica.
Figura 2: Depositi lipidici su una lente a contatto RGP causati da scarsa bagnabilità ed alterazione della qualità dello strato lipidico (Pietro Gheller).
Occhio secco e DGM
Durante l’International Workshop riguardante l’occhio secco è stata definita la condizione di occhio secco come una cronica infiammazione della superficie oculare, di livello variabile, principalmente associabile ad un aumento dell’osmolarità lacrimale, unitamente all’instabilità lacrimale. Ciò ha consentito di definire due sottotipi principali: EDE, ovvero occhio secco evaporativo, dove l’iperosmolarità è il risultato di un’eccessiva evaporazione del film lacrimale in presenza di una normale secrezione lacrimale, e l’ADDE, dove l’iperosmolarità è dovuta ad una limitata secrezione lacrimale (ridotta presenza di strato acquoso) in presenza di un normale tasso di evaporazione. Come riportato in precedenza, il deficit lipidico associato alla DGM è la causa più comune di EDE. Tuttavia, possono essere concepite anche forme ibride di occhio secco in cui la forma tipica di una classe può combinarsi con l’altra (Bron et al., 2009). Ad esempio, in una forma di DGM grave in cui il tasso di evaporazione è altamente compromesso, la perdita di sensibilità corneale potrebbe eliminare lo stimolo riflesso compensatorio alla secrezione acquosa e portare quindi ad un deficit funzionale secondario della ghiandola lacrimale. Al contrario, nell’ADDE, una forte riduzione nello spessore del film lacrimale potrebbe compromettere la distribuzione dello strato lipidico e dare origine ad un EDE secondario. Ne consegue che una situazione di occhio secco innescata da un deficit lacrimale diventa negli stadi successivi una combinazione di ADDE ed EDE. Un fenomeno che rende di difficile comprensione la causa primaria. Ogni tipologia di occhio secco, indipendentemente dalla causa scatenante, termina in uno scenario comune in cui l’iperosmolarità lacrimale e la cascata di eventi infiammatori creano un circolo vizioso che si autoalimenta (Baudouin, 2007). L’esposizione della superficie oculare a stress da essicamento innesca una risposta compensatoria di secrezione lacrimale che tende a controbilanciare un aumento dell’osmolarità e rallentare la progressione fisiopatologica. Sia l’iperosmolarità lacrimale che il raffreddamento della superficie oculare possono dare avvio a questo fenomeno. Le fibre corneali sensibili al freddo sono stimolate dall’iperosmolarità e potrebbero aumentare lo stimolo secretorio da parte della ghiandola lacrimale, oppure determinare un aumento della frequenza di ammiccamento. Inoltre, l’eccessiva evaporazione nell’EDE potrebbe amplificare queste risposte.
È ormai assodato che la perdita degli acini della ghiandola di Meibomio sia per lo più causata dall’età. Den e colleghi (Den et al., 2006) hanno riportato che il punteggio di atrofia ghiandolare, valutato attraverso la meibomiografia, diventava positivo dopo i 40 anni d’età, molto spesso associato ad un’alterazione della spremitura del meibum dalle ghiandole (Mathers et al., 1996). Un altro studio ha evidenziato come fosse presente una riduzione del numero di acini e del diametro degli stessi, associata all’età dei soggetti (Villani et al., 2013). Invecchiamento e stress ambientali possono eventualmente provocare una riduzione delle cellule staminali dei meibociti. L’esaurimento delle cellule staminali comporta una perdita degli acini ghiandolari e di conseguenza l’atrofia dell’intera ghiandola. Inoltre, la funzione delle ghiandole di Meibomio è fortemente influenzata dagli ormoni sessuali, in particolare dagli androgeni, i quali stimolano la sintesi e la secrezione dei lipidi ed inibiscono l’espressione dei geni coinvolti nella cheratinizzazione. (Khandelwal et al., 2012) Un deficit nell’azione degli androgeni, come avviene ad esempio nell’invecchiamento o nella sindrome di Sjögren, è associato a disfunzione delle ghiandole stesse con conseguente alterazione del profilo lipidico e quindi instabilità del film lacrimale (Krenzer et al., 2000).
Una correlazione positiva è stata riscontrata tra lo spessore delle ghiandole e la loro atrofia: maggiore è lo stato atrofico delle ghiandole maggiore è anche lo spessore delle stesse. Inoltre, l’atrofia ghiandolare è inversamente correlata all’osmolarità del film lacrimale e alla spremitura del meibum. Sembra quindi che l’aumento dello spessore sia una risposta compensatoria alla perdita ghiandolare e alla necessità maggiore di secrezione di meibum (Srinivasan et al., 2012).
Trattamenti e gestione della disfunzione – DGM
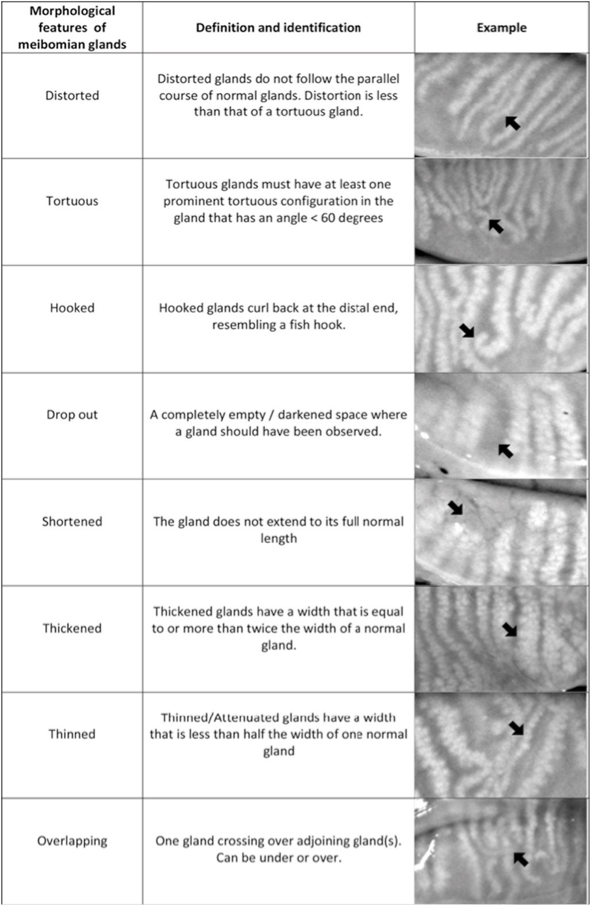
La DGM comporta alterazioni morfologiche delle ghiandole di Meibomio (Fig. 3), anomalie del bordo palpebrale e instabilità del film lacrimale causata da una variazione della composizione lipidica del meibum. I trattamenti sono quindi specifici ed atti a migliorare le performance di secrezione ghiandolare ed igiene palpebrale, mitigare la sintomatologia dell’occhio secco e migliorare la stabilità e la distribuzione del film lacrimale sulla superficie oculare.
- Sostituti lacrimali: l’instillazione di sostituti lacrimali aumenta il volume lacrimale riducendo l’osmolarità (Gilbard et al., 1984) e la frizione tra la congiuntiva tarsale delle palpebre e il bulbo oculare, nello specifico tra l’epitelio del lid wiper, l’epitelio corneale e congiuntivale. Migliora, inoltre, la distribuzione dello strato lipidico del film lacrimale (Yokoi et al., 2008).
In aggiunta, l’utilizzo delle lacrime artificiali consente di rimuovere tossine e detriti dalla superficie oculare, diluire la concentrazione di citochine infiammatore ed altre molecole pro-infiammatorie che si trovano nelle lacrime (Rashid et al., 2008). Negli ultimi anni, sono state presentate nel mercato lacrime artificiali contenenti lipidi in microparticelle, liposomi o componenti a base lipidica. Ciò consente di migliorare la stabilità dello strato lipidico delle lacrime senza alterare significativamente la qualità visiva. Goto e colleghi in uno studio randomizzato controllato hanno riscontrato un miglioramento della sintomatologia, dei dati oggettivi dell’interferometria dello strato lipidico, del BUT, della colorazione con rosa bengala e dell’evaporazione del film lacrimale dopo l’instillazione di lacrime artificiali a basso contenuto di lipidi (Goto et al., 2002).
- Impacchi caldi e spremitura ghiandolare: lo scopo di questo trattamento è quello di innalzare la temperatura locale nella zona palpebrale in modo da sciogliere e portare a fusione la secrezione meibomiana. L’alterazione della composizione del meibum nella DGM provoca un aumento del punto di fusione. Ciò può portare ad una ridotta dinamica secretoria e una stagnazione del meibum con conseguenti occlusioni parziali o totali dei dotti ghiandolari (McCulley, Shine, 1998). I trattamenti con scambio di calore possono essere attuati attraverso semplici impacchi caldi, umidi (garze per igiene palpebrale) o a secco (maschere riscaldate), oppure attraverso strumenti che emanano calore sotto forma di luce infrarossa o aria riscaldata (Ishida et al., 2008; Matsumoto et al., 2006). Olson e colleghi (Olson et al., 2013) hanno riportato che dopo 5 minuti di trattamento con garze calde riscaldate ad una temperatura di 40°C applicate sulla cute palpebrale, lo spessore dello strato lipidico è aumentato dell’80% in pazienti con DGM ostruttiva. Dopo 15 minuti di trattamento si è osservato un ulteriore aumento del 20%.
È consigliabile attuare successivamente procedure di igiene palpebrale quali spremitura manuale delle ghiandole e pulizia con salviette per igiene palpebrale imbevute di detergenti specifici per rimuovere dal margine palpebrale il meibum e gli eventuali residui cellulari, sebo, trucco ed agenti esterni.
- Trattamento a base di stimolazione luminosa: esistono due tipologie di dispositivi in grado di migliorare la produttività e la qualità del meibum: dispositivi che emanano luce pulsata e dispositivi che emanano radiazioni luminose dello spettro visibile a basso quantitativo energetico.
I primi sono dispositivi in grado di generare radiazioni luminose ad alta intensità, non coerenti e con lunghezza d’onda tra i 500 e i 1200 nm. Il trattamento consiste in 3-5 sedute, nelle quali le palpebre vengono coperte da occhialini di protezione e nella zona perioculare viene cosparso del gel per la protezione del derma. Vengono poi generati flash luminosi per la durata di qualche minuto sulle palpebre. Questa procedura aumenta notevolmente la funzione secretoria delle ghiandole, soprattutto quelle inferiori (Rong et al., 2018). Il calore generato dai raggi luminosi viene assorbito dall’emoglobina e consente di eliminare i vasi sanguigni superficiali, in particolare quelli di grande diametro (Baumler et al., 2007), promuovendo la riduzione del grado di infiammazione delle ghiandole di Meibomio. Il trattamento con luce pulsata è una procedura ambulatoriale ed a sola esclusività della classe medica.
La seconda tipologia di dispositivi invece, utilizza radiazioni luminose a basso quantitativo energetico emesse da sorgenti a LED. Il meccanismo con il quale questi dispositivi funzionano è la fotomodulazione cellulare, in aggiunta al trattamento termico. I fotoni della luce rossa vengono assorbiti dai cromofori presenti nei mitocondri cellulari, in particolare dall’ossidasi del citocromo c presente nella catena respiratoria della membrana mitocondriale. Successivamente ha inizio una cascata di reazioni atte a regolare la biostimolazione mitocondriale (Wong-Riley et al., 2005): aumento dell’attività enzimatica, del trasporto di elettroni, della respirazione mitocondriale e della produzione di ATP (Karu et al., 1999). Inoltre, l’applicazione di questi trattamenti consente la riduzione del dolore e dell’infiammazione, promuovendo la riparazione dei tessuti e la rigenerazione differenziale degli stessi (Chung et al., 2012).
A cura di:
Dott. Gianmarco Reverenna – Studio Optica
Figura 3: Alterazione della morfologia delle ghiandole di Meibomio (Villani et al., 2020)
Bibliografia
Alghamdi WM, Markoulli M, Holden BA, et al. Impact of duration of contact lens wear on the structure and function of the meibomian glands. Ophthalmic Physiol Opt 2016;36:120–131
Arciniega JC, Uchiyama E, Butovich IA. Disruption and destabilization of meibomian lipid films caused by increasing amounts of ceramides and cholesterol. Investig Ophthalmol Vis Sci. 2013;54(2):1352–1360.
Baudouin C. A new approach for better comprehension of diseases of the ocular surface. J Fr Ophtalmol 2007;30:239–246
Baumler W, Vural E, Landthaler M, Muzzi F, Shafirstein G. The effects of intense pulsed light (IPL) on blood vessels investigated by mathematical modeling. Lasers Surg Med. 2007;39(2):132–9
Bron AJ, Yokoi N, Gafney E, Tiffany JM. Predicted phenotypes of dry eye: proposed consequences of its natural history. Ocul Surf 2009;7:78–92
Chalmers R, Long B, Dillehay S, Begley C. Improving contact-lens related dryness symptoms with silicone hydrogel lenses. Optom Vis Sci 2008;85(8):778–84
Chung H, Dai T, Sharma SK, Huang YY, Carroll JD, Hamblin MR. The nuts and bolts of low-level laser (light) therapy. Ann Biomed Eng. Feb; 2012 40(2):516–533
Cox SM, Berntsen DA, Chatterjee N, et al. Eyelid margin and meibomian gland characteristics and symptoms in lens wearers. Optom Vis Sci 2016;93: 901–908
Daniel Nelson J, Shimazaki J, Benitez-del-Castillo JM, Craig J, McCulley JP, Den S, et al. The international workshop on meibomian gland dysfunction: report of the definition and classification subcommittee. Investig Ophthalmol Vis Sci 2011;52: 1930–7
Den S, Shimizu K, Ikeda T, Tsubota K, Shimmura S, Shimazaki J. Association between meibomian gland changes and aging, sex, or tear function. Cornea 2006;25:651–655
Dunn, A.C., Urueña, J.M., Huo, Y. et al. Lubricity of Surface Hydrogel Layers. Tribol Lett 49, 2013, 371–378
Efron N, Brennan NA, Morgan PB, Wilson T. Lid wiper epitheliopathy. Prog Retin Eye Res. 2016 Jul;53:140-174
Gilbard JP, Carter JB, Sang DN, Refojo MF, Hanninen LA, Kenyon KR. Morphologic effect of hyperosmolarity on rabbit corneal epithelium. Ophthalmology. 1984;91:1205–1212
Goto E, Shimazaki J, Monden Y, et al. Low-concentration homogenized castor oil eye drops for noninflamed obstructive meibomian gland dysfunction. Ophthalmology. 2002;109:2030–2035
Ishida R, Matsumoto Y, Onguchi T, et al. Tear film with “Orgahexa EyeMasks” in patients with meibomian gland dysfunction. Optom Vis Sci. 2008;85:684–691
Karu T, Pyatibrat L, Kalendo G. Irradiation with He-Ne laser increases ATP level in cells cultivated in vitro. J Photochem Photobiol B. Mar; 1995 27(3):219–223
Khandelwal P, Liu S, Sullivan DA. Androgen regulation of gene expression in human meibomian gland and conjunctival epithelial cells. Mol Vis 2012;18:1055–1067
Korb DR, Henriquez AS. Meibomian gland dysfunction and contact lens intolerance. J Am Optom Assoc 1980;51:243–251
Krenzer KL, Dana MR, Ullman MD, Cermak JM, Tolls DB, Evans JE, et al. Effect of androgen deficiency on the human meibomian gland and ocular surface. J Clin Endocrinol Metab 2000;85:4874–4882
Machalinska A, Zakrzewska A, Adamek B, et al. Comparison of morphological and functional meibomian gland characteristics between daily contact lens wearers and nonwearers. Cornea 2015;34:1098–1104
Maissa C, Guillon M, Cockshott N, Garofalo RJ, Lemp JM, Boclair JW. Contact lens lipid spoliation of hydrogel and silicone hydrogel lenses. Optom Vis Sci 2014; 91(9):1071–83
Mathers WD, Lane JA, Zimmerman MB. Tear film changes associated with normal aging. Cornea 1996;15:229–234
Matsumoto Y, Dogru M, Goto E, et al. Efficacy of a new warm moist air device on tear functions of patients with simple meibomian gland dysfunction. Cornea. 2006;25:644–650
McCulley JP, Shine WE. Meibomian secretions in chronic blepharitis. Adv Exp Med Biol. 1998;438:319–326
Nelson JD, Shimazaki J, Benitez-del-Castillo JM, et al. The international workshop on meibomian gland dysfunction: report of the definition and classification subcommittee. Invest Ophthalmol Vis Sci 2011;52:1930–1937
Nichols KK, Foulks GN, Bron AJ, Glasgow BJ, Dogru M, Tsubota K, et al. The international workshop on meibomian gland dysfunction: executive summary. Investig Ophthalmol Vis Sci 2011;52:1922
Olson MC, Korb DR, Greiner JV. Increase in tear film lipid layer thickness following treatment with warm compresses in patients with meibomian gland dysfunction. Eye Contact Lens. 2003;29: 96–99
Ong BL, Larke JR. Meibomian gland dysfunction: Some clinical, biochemical and physical observations. Ophthalmic Physiol Opt 1990;10:144–148
Rashid S, Jin Y, Ecoiffier T, Barabino S, Schaumberg DA, Dana MR. Topical omega-3 and omega-6 fatty acids for treatment of dry eye. Arch Ophthalmol. 2008;126:219–225
Rong B, Tang Y, Tu P, et al. Intense pulsed light applied directly on eyelids combined with meibomian gland expression to treat meibomian gland dysfunction. Photomed Laser Surg. 2018;36(6): 326–32
Srinivasan S, Menzies K, Sorbara L, Jones L. Infrared imaging of meibomian gland structure using a novel keratograph. Optom Vis Sci 2012;89:788–94
Tomlinson A, Bron AJ, Korb DR, Amano S, Paugh JR. The international workshop on meibomian gland dysfunction: report of the diagnosis subcommittee. Invest Ophthalmol Vis Sci 2011;52:2006–49
Varikooty J, Keir N, Richter D, Jones LW, Woods C, Fonn D. Comfort response of three silicone hydrogel daily disposable contact lenses. Optom Vis Sci 2013;90(9): 945–53
Villani E, Ceresara G, Beretta S, et al. In vivo confocal microscopy of meibomian glands in contact lens wearers. Invest Ophthalmol Vis Sci 2011;52:5215–5219
Villani E, Magnani F, Viola F, Santaniello A, Scorza R, Nucci P, et al. In vivo confocal evaluation of the ocular surface morpho-functional unit in dry eye. Optom Vis Sci 2013;90:576–586
Villani E, Marelli L, Dellavalle A, Serafino M, Nucci P. Latest evidences on meibomian gland dysfunction diagnosis and management. Ocul Surf. 2020 Oct;18(4):871-892
Wong-Riley MT, Liang HL, Eells JT, et al. Photobiomodulation directly benefits primary neurons functionally inactivated by toxins: role of cytochrome c oxidase. J Biol Chem. Feb 11; 2005 280(6):4761–4771
Yokoi N, Yamada H, Mizukusa Y, et al. Rheology of tear film lipid layer spread in normal and aqueous tear-deficient dry eyes. Invest Ophthalmol Vis Sci. 2008;49:5319–5324
Young G, Chalmers RL, Napier L, Hunt C, Kern J. Characterizing contact lens- related dryness symptoms in a cross-section of UK soft lens wearers. Cont Lens Anterior Eye 2011;34(2):64–70